De gigantische vrachtwagenkonvooien rijden richting Ottawa, vergezeld van enorme aantallen supporters en media-aandacht.
Tegelijkertijd wordt Pfizers Paxlovid relatief stilletjes verspreid over Noord-Amerika, Europa, het Verenigd Koninkrijk en daarbuiten.
Het is een reeks pillen voor corona - en het is het tweede deel van een een-tweetje dat begon met de mRNA coronaprik van het bedrijf. Tezamen stuwen ze Pfizer naar duizelingwekkende winst- en marktkapitalisatieniveaus.
Er is echter weinig of geen 'pax' (het Latijnse woord voor vrede) te verwachten van deze pillen. Paxlovid is tot nu toe op heel weinig mensen getest. Het wordt helemaal niet onderzocht op gevaccineerde mensen of mensen die corona hebben gehad. De pillen hebben een negatieve interactie met veel op grote schaal gebruikte medicijnen. En natuurlijk worden de studies gemanipuleerd om schijnbaar goede resultaten te produceren.
Ik heb gehoord dat achter de schermen sommige medewerkers van regelgevende instanties het beu zijn om toe te geven aan de intense druk van politici, volksgezondheidsambtenaren en Big Pharma. Zij willen niet dat het publiek deze uiterst slecht bestudeerde en potentieel zeer gevaarlijke reeks pillen slikt.
Iedere dosis Paxlovid bestaat uit één ritonavir pil -- een hergebruikt oud HIV medicijn -- en twee pillen van een nieuw medicijn met de naam nirmatrelvir. Beide medicijnen zijn proteaseremmers.
De combinatie nirmatrelvir/ritonavir werd op 22 december 2021 door de Food and Drug Administration toegelaten voor gebruik in de VS onder voorwaardelijke autorisatie voor noodgebruik (EUA) en op 17 januari 2022 door Health Canada voor gebruik in Canada.
Ook elders wordt het in hoog tempo goedgekeurd: zo kreeg het middel op 26 december 2021 een vergunning in Israël, op 27 december 2021 in Zuid-Korea, op 31 december 2021 in het Verenigd Koninkrijk en op 21 januari 2022 in Frankrijk.
Het wordt toegestaan voor jongeren - 12 jaar en ouder - en volwassenen in de VS, Israël en Zuid-Korea. In andere landen, waaronder het Verenigd Koninkrijk en Canada, wordt het toegestaan voor mensen van 18 jaar en ouder.
(Let wel, autorisatie is geen goedkeuring; het is een zeer snelle evaluatie gevolgd door het groene licht om tientallen miljoenen mensen het te laten nemen, omdat we ons zogenaamd in een ongekende volksgezondheidscrisis bevinden, vergelijkbaar met een oorlog.)
Ook bleek uit een test in een petrischaaltje door wetenschappers van Pfizer dat het enig effect kan hebben op Omicron -- zie de eerste alinea op blz. 36 van het Canadese specificatieblad ( alias productmonografie) van 22 januari daarover. Gebaseerd op dit flinterdunne bewijsmateriaal, berichten de reguliere media op grote schaal dat "de pillen naar verwachting effectief zullen zijn tegen Omicron."
De nirmatrelvir/ritonavir-pillen worden toegelaten voor gebruik door mensen met een positieve coronatest, die milde of matige symptomen hebben en geacht worden 'een hoog risico te lopen op progressie naar ernstige COVID-19.'
Maar hoe wordt een hoog risico gedefinieerd door Pfizer?
60 jaar of ouder zijn. Of overgewicht. Of een hoge bloeddruk. Of een aantal andere dingen - waaronder het hebben van "andere aandoeningen of factoren (bijv. ras of etniciteit) die patiënten een hoog risico op progressie kunnen geven." (Zie pagina 8 van het Canadese specificatieblad van 22 januari.)
Dat is een extreem ruime definitie.
Een ander alarmerend feit is dat de Amerikaanse en Canadese besluiten om nirmatrelvir/ritonavir toe te staan, slechts gebaseerd waren op tussentijdse analyses van een lopend onderzoek. Deze studie ving aan op 25 augustus 2021 en zal volgens de planning eindigen rond 24 april 2022.
In totaal waren slechts ongeveer 1.000 mensen gerandomiseerd om nirmatrelvir/ritonavir te krijgen op het moment dat de Amerikaanse en Canadese autoriteiten hun fiat gaven.
(Het is erg lastig te achterhalen wat de specifieke cijfers zijn - zowel het persbericht van Pfizer van 5 november 2021, waarin de door de FDA onderzochte tussentijdse analyse wordt beschreven, als de Canadese productmonografie van 17 januari 2022 - die een tussentijdse analyse van een iets latere datum bevat - bevatten een reeks cijfers, evenals verschillende soorten gegevensanalyses.)
Voorts bestond slechts 13% van dat kleine aantal uit mensen van 65 jaar of ouder, en slechts 3% was 75 jaar en ouder. (Zie rubriek 1.2, getiteld 'Geriatrie' op pagina 4 van de Canadese productmonografie voor Paxlovid van 17 januari 2022.)
Daarnaast werden zelfs deze tussentijdse resultaten tot het uiterste gemanipuleerd in het uitschrijven van de studie (meer hierover hieronder) - wat in het geval van de VS simpelweg uit een persbericht van Pfizer van 5 november 2021 bestond.
En, voorzover ik kan nagaan, maakte Pfizer niet eens de originele gegevens openbaar die het aan Health Canada leverde. Bovendien bevatte het persbericht van 17 januari 2022, waarin het bedrijf de toelating in Canada aankondigde, heel weinig details
Het was allemaal erg voorspelbaar.
Dat blijkt duidelijk uit het feit dat de Amerikaanse regering meer dan een maand voor de autorisatie van de FDA - op 18 november 2021 - een overeenkomst van 5,3 miljard dollar sloot voor 10 miljoen kuren nirmatrelvir/ritonavir (d.w.z. 530 dollar per kuur), in afwachting van autorisatie door de FDA.
Hetzelfde laken een pak in Canada: op 3 december 2021 kondigde de Canadese regering aan dat zij zich ertoe verbond een eerste miljoen kuren nirmatrelvir/ritonavir van Pfizer te kopen, in afwachting van autorisatie door Health Canada. Dat is ongeveer $690 miljoen (Canadese dollars) waard als je rekent op basis van $530 US per kuur. (Een "kuur" is het totale aantal doses dat nodig is om een behandelingskuur te voltooien.)
(In dezelfde aankondiging stond dat de Canadese regering ook een overeenkomst had getekend met Merck om 500.000 kuren van Merck's coronapil molnupiravir te kopen -- met opties om nog eens 500.000 kuren te kopen -- ook in afwachting van autorisatie door Health Canada.) (Molnupiravir werd korte tijd later, op 23 december 2021, goedgekeurd door de Amerikaanse FDA, ondanks aanzienlijke bezwaren. Deze omvatten de lage effectiviteit, de hoge giftigheid en de mogelijkheid voor vrouwen die het tijdens de zwangerschap gebruiken om kinderen met geboorteafwijkingen ter wereld te brengen. De FDA heeft Merck toestemming gegeven om het te verkopen aan mensen van 18 jaar of ouder met milde tot matige corona die positief testen en een "hoog risico" lopen op het ontwikkelen van ernstige Covid. Health Canada heeft nog geen toestemming gegeven. En de media melden dat andere landen er ook koudwatervrees voor hebben.)
Er is nog meer. Zo is nirmatrelvir/ritonavir helemaal niet getest bij mensen die niet zijn gevaccineerd en/of geen corona hebben gehad. Desondanks behoren zij tot de mensen die de ambtenaren er als eerste voor in de rij willen hebben.
Ook wordt het helemaal niet getest op zwangere vrouwen of vrouwen die borstvoeding geven.
Pfizer zegt op pagina 12 van de productmonografie dat Paxlovid "niet dient te worden gebruikt door zwangere vrouwen, tenzij de potentiële voordelen opwegen tegen de potentiële risico's voor de foetus."
Maar er is geen dergelijke waarschuwing voor het gebruik van nirmatrelvir/ritonavir door vrouwen die borstvoeding geven.
Zoals ik boven reeds opmerkte, bestaat elke dosis Paxlovid uit twee tabletten nirmaltrelvir en één tablet ritonavir. Elke reeks van drie pillen moet vijf dagen lang tweemaal per dag worden ingenomen, te beginnen binnen vijf dagen na aanvang van symptomen.
Ritonavir wordt sinds 1996 gebruikt bij mensen die positief testen op HIV. Het is algemeen bekend dat het ernstige, levensbedreigende aandoeningen kan veroorzaken, zoals pancreatitis, hartritmestoornissen, leverproblemen, ernstige huiduitslag en allergische reacties.
Toch is nirmatrelvir/ritonavir niet onderzocht bij mensen met een leverfunctiestoornis. En noch Pfizer, noch overheidsambtenaren waarschuwen dat nirmatrelvir/ritonavir niet mag worden ingenomen door bijvoorbeeld mensen met een verhoogd risico op het ontwikkelen van een abnormale leverfunctie (waaronder mensen die hepatitis B of hepatitis C hebben gehad of verhoogde resultaten vertoonden op leverfunctietesten).
In plaats daarvan worden ouderen en mensen die in armoede leven of anderszins benadeeld zijn, vooraan in de rij gezet.
Een artikel in CBC News van 25 januari meldt dat Canada's plaatsvervangend hoofd van de volksgezondheidsdienst, Howard Njoo, aanbeveelt dat "mensen die immuungecompromitteerd zijn, 80 jaar of ouder zijn, of [zij] die geen toegang hebben tot de gezondheidszorg vanwege geografische of sociaal-economische problemen[,] als eersten mogen -- ongeacht hun vaccinatiestatus."
Quebec is een van de eerste plaatsen die klaar staan om het middel bij deze kwetsbare mensen te gaan gebruiken. In maart verwachten ze genoeg pillen te ontvangen om meer dan 25.000 mensen te behandelen. Dat is inclusief degenen met "ernstige aandoeningen die niet gevaccineerd kunnen worden." Daarna zullen ze de wachtrij openstellen voor anderen.
Het lijkt er dus op dat politici, regeringsambtenaren en Pfizer de vraag aanwakkeren volgens hetzelfde draaiboek dat ze bij de vaccins gebruikten.
Ze stellen in eerste instantie maar een relatief klein aantal pillen beschikbaar.
En de reguliere media helpen om het te hypen. Alleen al een verslag van CBC -- door de journaliste uit Montreal Verity Stevenson van 18 januari -- noemde het een "gewild" medicijn dat "geprezen wordt voor zijn potentieel om het aantal ziekenhuisopnames door het virus te verminderen" middels Pfizers rapportage "dat Paxlovid het risico van ziekenhuisopname of overlijden verminderde met een indrukwekkende 89 procent in vergelijking met een placebo."
En hier is nog een voorbeeld van de over het algemeen zeer positieve berichtgeving; het staat vandaag in de Toronto Star.
Een artikel in de National Post van 25 januari 2022 vormt hierop enigszins een uitzondering: de auteur, Tom Blackwell, wijst op het probleem dat Paxlovid de werking van andere medicijnen kan verstoren (meer hierover hieronder). Hij vermeldt echter niet de meeste andere ernstige nadelen van de pillen.
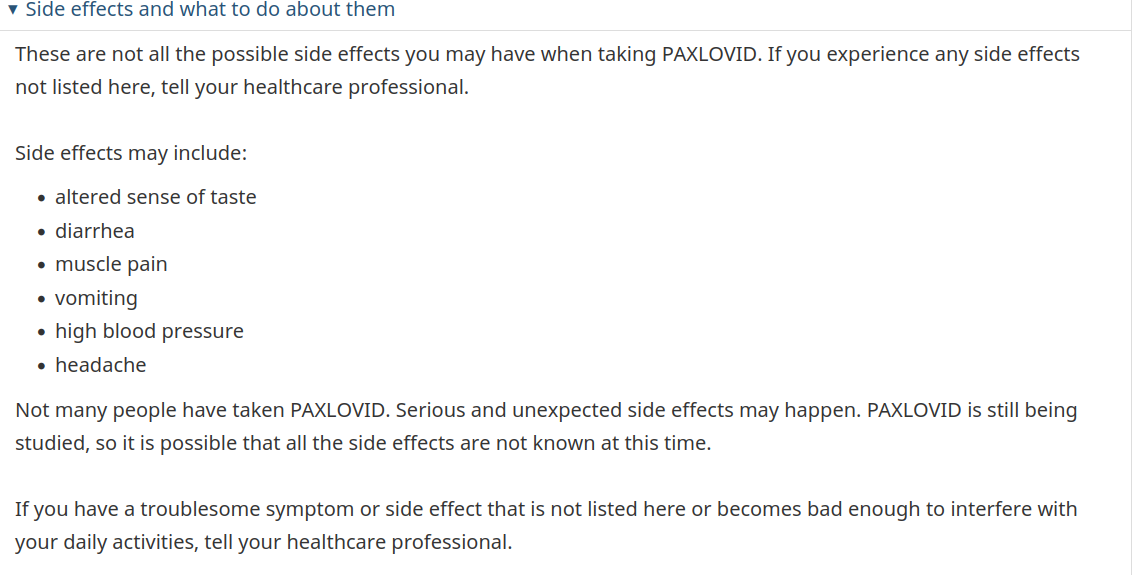
Maar zelfs de Canadese federale regering geeft toe, op haar webpagina over de pil voor het grote publiek, dat "Niet veel mensen Paxlovid hebben ingenomen. Ernstige en onverwachte bijwerkingen kunnen voorkomen. Paxlovid wordt nog steeds onderzocht, dus het is mogelijk dat niet alle bijwerkingen op dit moment bekend zijn." [Vetgedrukt door mij toegevoegd].
En verderop op diezelfde pagina staat dat mensen alle veronderstelde bijwerkingen direct aan Health Canada moeten melden.
Helaas weten we echter uit de schaarse meldingen van ernstige bijwerkingen en sterfgevallen als gevolg van bijvoorbeeld de coronaprikken, dat het zeer onwaarschijnlijk is dat de federale overheid al deze meldingen trouw zal inventariseren en openbaar zal maken.
Van haar kant heeft de FDA Pfizer gevraagd om "ernstige ongewenste voorvallen en alle medicatiefouten in verband met het gebruik van Paxlovid" te melden" als onderdeel van de EUA. De FDA heeft ook bepaald dat zorginstellingen en zorgverleners die Paxlovid ontvangen, ernstige ongewenste voorvallen en medicatiefouten zullen opsporen en rapporteren. Het is echter zeer onwaarschijnlijk dat ook dit zal leiden tot een volledige en eerlijke openbare rapportage.
(De FDA heeft het bedrijf ook gevraagd om verdere onderzoeksresultaten met betrekking tot veiligheid en effectiviteit aan de FDA te verstrekken totdat de studie een einde neemt in april.)
Dus ze proberen niet eens te doen alsof de veiligheid en effectiviteit ervan bewezen zijn.
Per slot van rekening is dit het farmacocene tijdperk in de geschiedenis van onze planeet.
Hier zijn nog drie van de vele alarmsignalen rond Paxlovid:
- De FDA van de VS heeft de belangrijke stap om input te krijgen van een adviespanel achterwege gelaten alvorens een noodautorisatie (EUA) te verlenen voor Paxlovid.
(In het geval van molnupiravir daarentegen werd het eind november 2021 bijeengeroepen [de leden hielden een stemming, 13 tegen 10, terwijl de FDA op 23 december 2021 autorisatie verleende].)
Ik ontdekte dit toen ik stuitte op een artikel van 6 januari 2022 op SonsOfLibertyMedia.com over Paxlovid. Het artikel beschrijft, naast vele andere inzichtelijke informatie, dit artikel uit Bloomberg Law van 22 december 2021 over de controverse veroorzaakt door het overslaan van deze belangrijke stap door de FDA.
De panelvergaderingen zijn gewoonlijk niet meer dan pro forma goedkeuring, maar het overslaan ervan is desondanks zeer ongebruikelijk.
- Ritonavir is niet alleen een proteaseremmer, het vermindert ook de activiteit van het zeer belangrijke enzym CYP3A4. CYP3A4 wordt geproduceerd in de lever. Daar speelt het een centrale rol bij het metaboliseren (d.w.z. afbreken) van een groot aantal geneesmiddelen en gifstoffen; dit is noodzakelijk voordat de geneesmiddelen en toxinen uit het lichaam kunnen worden verwijderd.
De website van de Canadese federale overheid over Paxlovid geeft toe dat "veel geneesmiddelen een interactie hebben met Paxlovid. Het nemen van Paxlovid met deze medicijnen kan leiden tot ernstige of levensbedreigende bijwerkingen." [Vetgedrukt door mij toegevoegd.]
In totaal zijn er meer dan 100 medicijnen waarvan Pfizer zegt dat ze niet samen met Paxlovid ingenomen mogen worden. Het gaat om zeer veel op grote schaal gebruikte medicijnen zoals lidocaïne, warfarine, fenobarbital, erytromycine, sint-janskruid, fentanyl, methadon, midazolam en prednison.
- De studieresultaten in het persbericht van Pfizer US van 5 november 2021 zijn gebaseerd op 'intentie-tot-behandelen' statistische analyses. Deze zijn in het geheel niet rigoureus.
En voor alle duidelijkheid, Pfizers persbericht-studie liet het daar niet bij - de intentie-tot-behandelen analyses gebruiken een 'aangepaste' aanpak. Specifiek omvatten ze, bijvoorbeeld, mensen "die bij aanvang geen COVID-19 therapeutische mAb [monoklonaal antilichaam] behandeling kregen en waarvan ook niet werd verwacht dat ze die zouden krijgen."
Dit verzin je toch niet.
Ik hoop van harte dat de medewerkers die zich achter de schermen verzetten tegen de druk om Paxlovid aan veel mensen te laten geven zullen zegevieren.
Zie: https://www.rosemaryfrei.ca/pfizers-covid-poison-pill/
---------
Over: Na het behalen van een MSc in moleculaire biologie aan de Faculteit Geneeskunde van de Universiteit van Calgary, werd Rosemary Frei freelance schrijfster. De daaropvolgende 22 jaar was ze medisch schrijfster en journaliste. Begin 2016 maakte ze weer een ommezwaai naar fulltime, onafhankelijk activisme en onderzoeksjournalistiek. Haar website is RosemaryFrei.ca.





Reacties van Lezers
voor onze Nieuwsbrief